Trước đó, ngày 24/9/2020, Cục Quản lý Dược đã có công văn số 15295/QLD-CL về việc xử lý mẫu thuốc Viên nén bao phim Vitamin C 300mg (Acid ascorbic 300 mg), SĐK: VD-28097-17; Số lô: 18001; NSX: 04/10/2018; HD: 03/10/2021.
Theo đó, Cục Quản lý Dược yêu cầu Công ty cổ phần dược phẩm Trung ương 1 - Pharbaco phối hợp với cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc Nhà nước tiến hành lấy mẫu bổ sung ít nhất 03 mẫu thuốc để kiểm tra chất lượng thuốc.
Ngày 04/05/2021, Cục Quản lý Dược đã có công văn số 4697/QLD-CL hướng dẫn công ty Pharbaco lấy mẫu bổ sung để kiểm tra chất lượng thuốc.
Tiếp đó, Cục Quản lý Dược có công văn số 6457/QLD-CL ngày 04/06/2021, yêu cầu công ty Pharbaco báo cáo tình hình sản xuất, phân phối lô thuốc Viên nén bao phim Vitamin C 300mg để có căn cứ xử lý tiếp theo.
Theo báo cáo của công ty Pharbaco, đơn vị này không thể liên hệ và thu thập thông tin, hồ sơ phân phối sản phẩm Viên nén bao phim Vitamin C 300mg nói trên; không xác định được các cơ sở kinh doanh và các cơ sở khám chữa bệnh đã mua thuốc hoặc còn bảo quản, tồn trữ sản phẩm Viên nén bao phim Vitamin C 300mg và không thực hiện việc kiểm nghiệm thuốc lưu hành trên thị trường.
Đến ngày 29/7/2021, Công ty CPDP Trung ương 1 - Pharbaco có công văn số 761/CVPHARBACO gửi đến Cục Quản lý Dược, đề nghị tự hủy số lượng hàng trả về hiện đang bảo quản tại kho của Công ty do hạn dùng của lô thuốc còn ngắn (dưới 3 tháng).

Theo tìm hiểu, thuốc Viên nén bao phim Vitamin C có thành phần là Acid ascorbic 300 mg, được chỉ định: Phòng và điều trị thiếu vitamin C ( bệnh Scorbut) và các chứng chảy máu do thiếu vitamin C; Tăng sức đề kháng ở cơ thể khi mắc bệnh nhiễm khuẩn, cảm cúm , mệt mỏi, nhiễm độc; Phối hợp với các thuốc chống dị ứng.
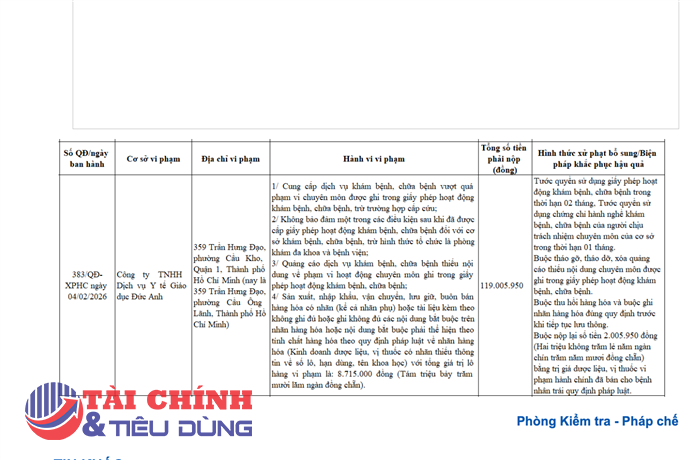
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược đã ban hành công văn số 9171/QLD-CL ngày 06/08/2021, thông báo thu hồi toàn quốc Viên nén bao phim Vitamin C 300mg, SĐK: VD-28097-17; Số lô: 18001; NSX: 04/10/2018; HD: 03/10/2021 do Công ty cổ phần dược phẩm Trung ương 1 - Pharbaco sản xuất.

Nội dung công văn nêu rõ, công ty Pharbaco phải gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng sản phẩm và tiến hành thu hồi toàn bộ lô thuốc nêu trên.
Ngoài ra, báo cáo thu hồi, hồ sơ thu hồi (số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc) về Cục trong vòng 33 ngày.
Sở Y tế các tỉnh thành phố trực thuộc Trung ương có trách nhiệm thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên.
Đồng thời, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan./.
Nguồn: thuongtruong.com.vn